心理所研究揭示疼痛敏感性个体差异的神经生物标记物
疼痛敏感性存在很大的个体差异:同一个疼痛刺激对某人而言可能痛得无法忍受,但对另一个人而言却可能完全不痛。这一个体差异的神经基础为何是疼痛领域的核心问题之一。这一问题虽然早已受到疼痛研究者的关注[1],但至今仍未得到明确的解答,最近两项100人左右的研究甚至得出了完全相反的结论[2-3]。
近期,中国科学院心理研究所胡理研究组开展了一项大样本研究,利用总样本量达1046的六个功能磁共振数据集(图1),系统探究了脑激活是否可反映疼痛敏感性个体差异这一问题,并开发了一个高度可泛化的疼痛敏感性神经生物标记物。
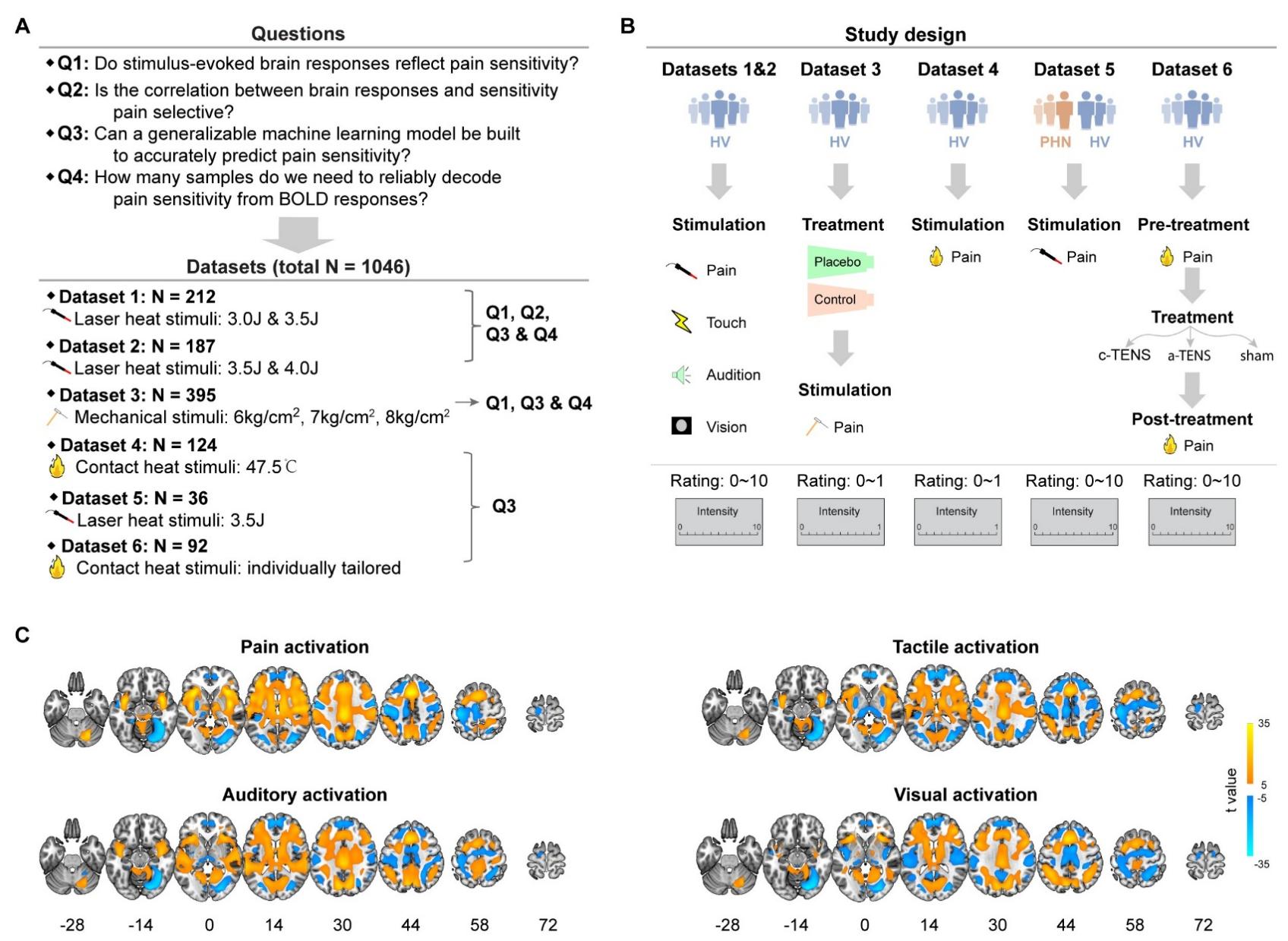
图1. 研究问题、数据集和实验设计概况
研究团队首先分析了自主采集的大样本功能磁共振数据集,发现疼痛刺激诱发的脑激活与疼痛敏感性存在显著相关,这一结果在另一个大样本数据集中也得到了很好的重复(图2A、2B)。研究团队进一步利用重采样的方法,发现了样本量对脑激活与疼痛敏感性的相关有很大影响,即便样本量达到210,也只有25%的体素和疼痛敏感性的关系能够被稳定检验出来(图2C)。这说明以往样本量100左右的研究仍可能不具有充足的统计检验力,因而得出了相互矛盾的结果。
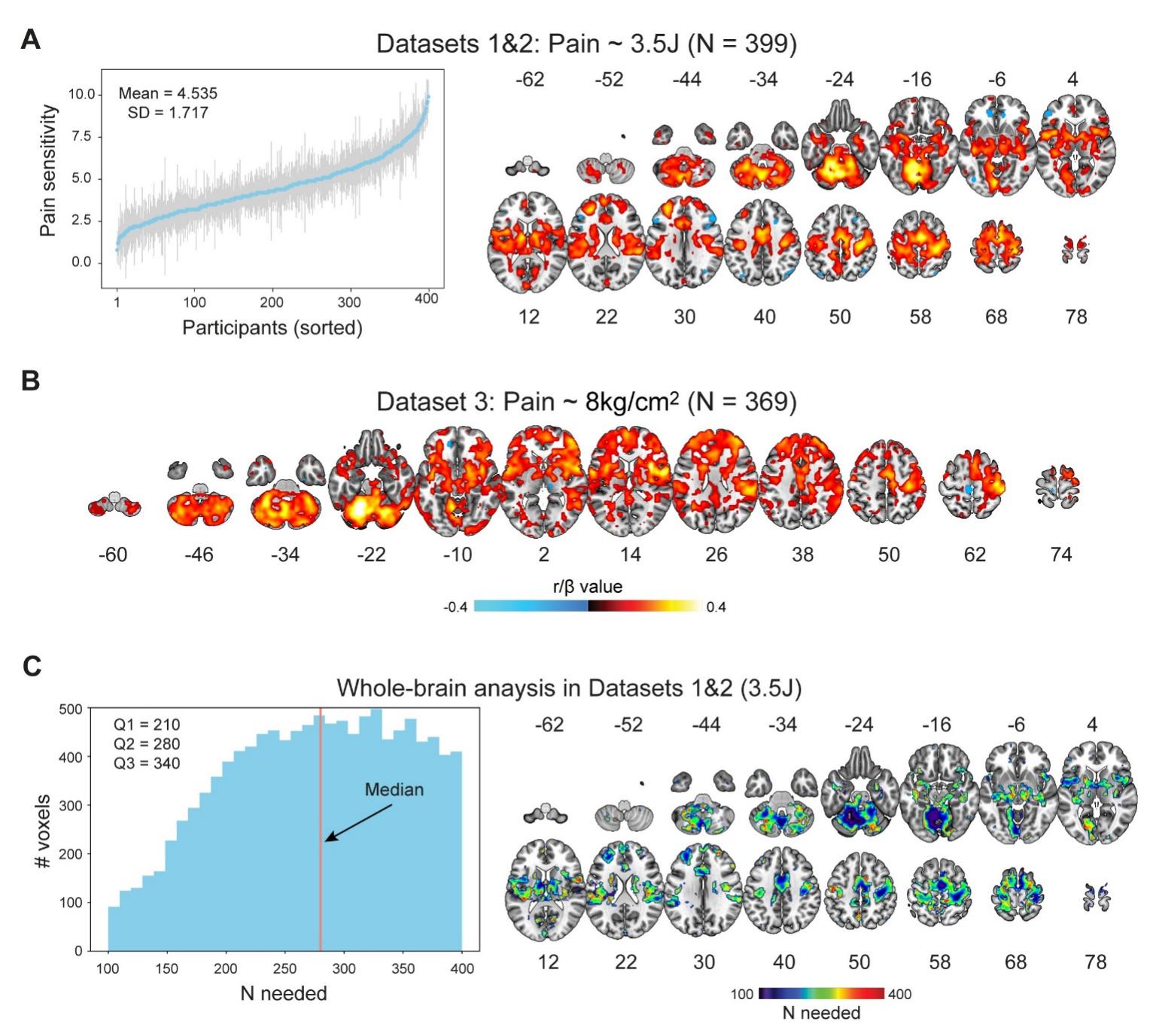
图2. 脑激活反映疼痛敏感性个体差异
接着,研究团队通过对非痛刺激诱发脑激活的分析,发现脑激活和非痛感觉敏感性个体差异也存在相关,但这一相关明显弱于脑激活和疼痛敏感性的相关。这说明脑激活和感觉敏感性个体差异的关系并非是疼痛特异的,但脑激活对疼痛敏感性的编码具有一定的偏向性。
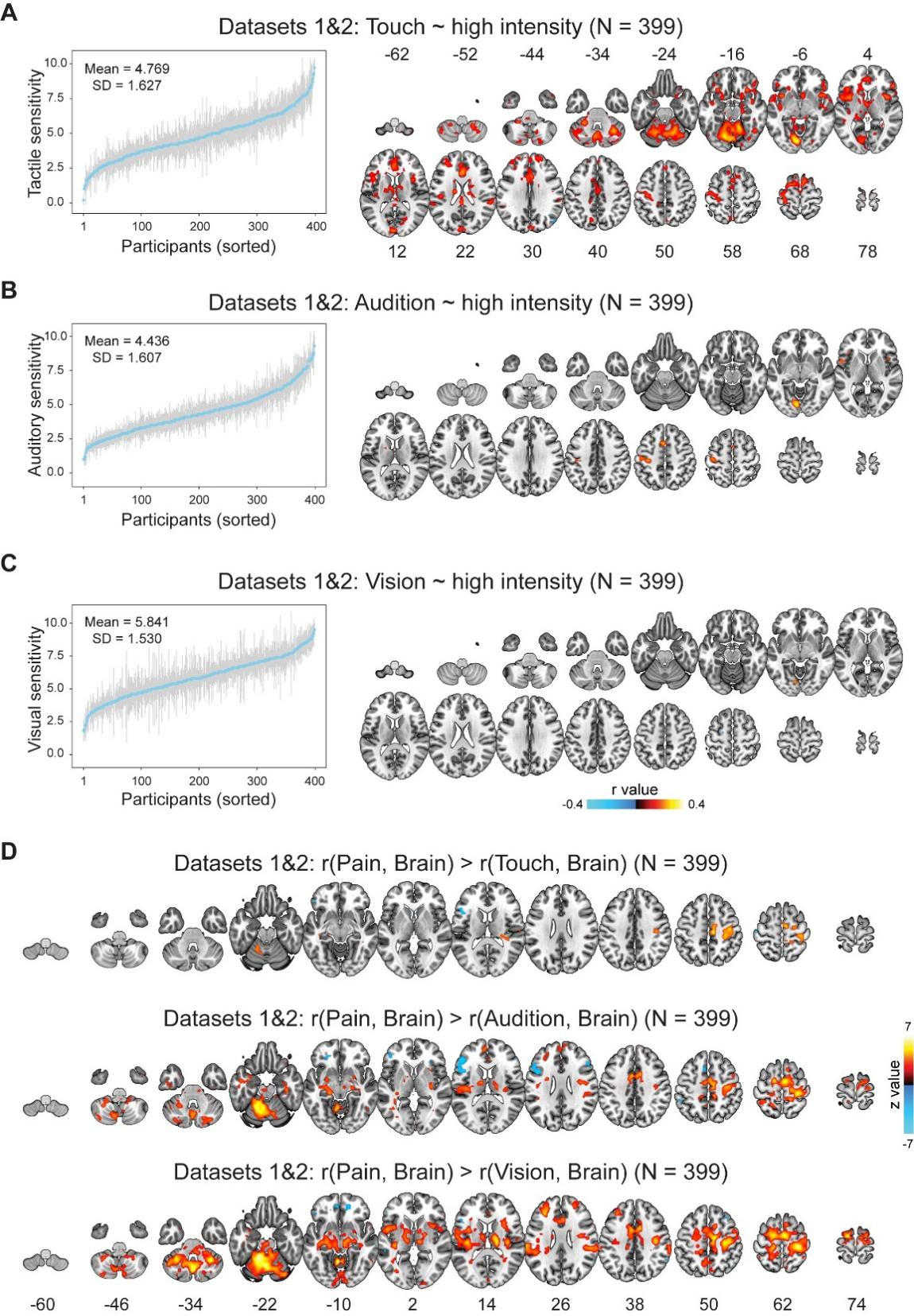
图3. 脑激活对疼痛敏感性的编码具有偏向性
基于上述研究结果,研究团队利用机器学习技术开发了一个疼痛敏感性预测模型(Neuroimaging-based Indicator of Pain Sensitivity [NIPS])。该模型在激光热痛、接触式热痛、机械诱发痛中均显示出对疼痛敏感性的显著预测能力(图4)。不仅如此,NIPS还能预测带状疱疹后遗神经痛(PHN)患者的疼痛敏感性。通过对比NIPS和经典疼痛预测模型[4-5],研究团队发现只有NIPS在所有数据集中都显著预测疼痛敏感性。更值得关注的是,NIPS甚至可以预测安慰剂和经皮神经电刺激的镇痛作用(图4D)。这些结果证明NIPS具有高度可泛化性,且具备潜在的临床应用价值。
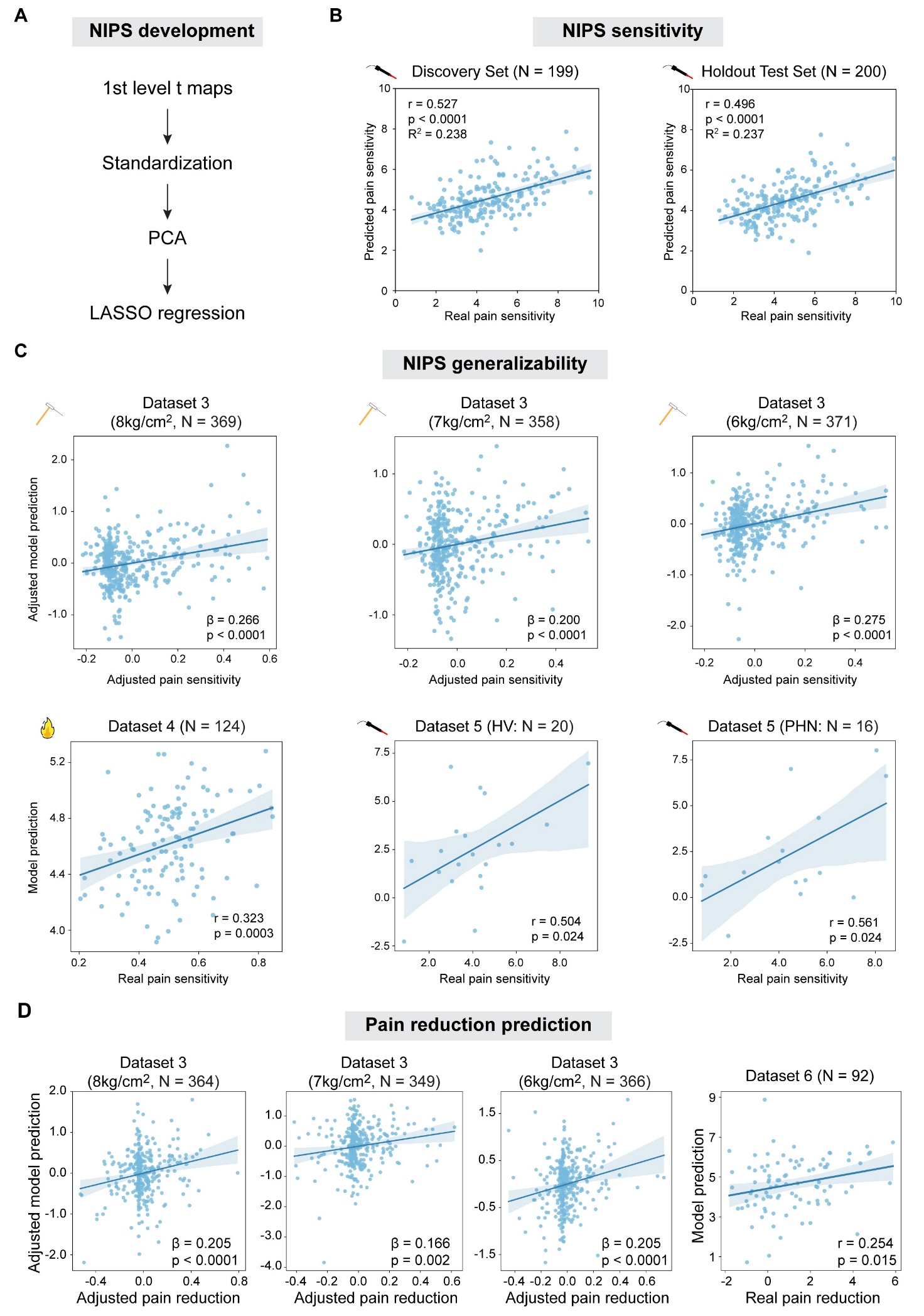
图4. NIPS模型的高度可泛化性
综上,这项研究揭示了在样本量较大的前提下,疼痛诱发脑激活可稳定反映疼痛敏感性个体差异,并开发了一个高度可泛化的疼痛敏感性神经生物标记物。该研究解决了脑激活是否可反映疼痛敏感性这一难题,为客观量化疼痛敏感性提供了关键脑指标,凸显了大样本数据结合人工智能算法在解决疼痛基础研究与临床应用问题中的重要性。研究结果对基于脑活动的疼痛慢性化早期筛查和开发个体化的疼痛干预手段具有重要启示意义。
该研究获得了北京市自然科学基金、国家自然科学基金以及国家重点研发计划的资助。
相关成果已在线发表于Advanced Science。心理所博士毕业生张立波为论文第一作者,胡理研究员为论文通讯作者。心理所吕雪靖副研究员、张会娟助理研究员、博士毕业生魏朝行、孔亚卓研究员、涂毅恒研究员及意大利技术研究院Giandomenico Iannetti研究员为该研究作出重要贡献。
论文信息:Zhang, L.-B., Lu, X.-J., Zhang, H.-J., Wei, Z.-X., Kong, Y.-Z., Tu, Y.-H., Iannetti, G.D., and Hu, L*. (2025). A Replicable and Generalizable Neuroimaging-Based Indicator of Pain Sensitivity Across Individuals. Advanced Science, e03373. https://doi.org/10.1002/advs.202503373
相关文献:
1. Coghill, R.C., McHaffie, J.G., and Yen, Y.-F. (2003). Neural correlates of interindividual differences in the subjective experience of pain. Proceedings of the National Academy of Sciences 100, 8538–8542.
2. Hoeppli, M.E., Nahman-Averbuch, H., Hinkle, W.A., Leon, E., Peugh, J., Lopez-Sola, M., King, C.D., Goldschneider, K.R., and Coghill, R.C. (2022). Dissociation between individual differences in self-reported pain intensity and underlying fMRI brain activation. Nature Communications 13, 3569.
3. Gim, S., Lee, D.H., Lee, S., and Woo, C.-W. (2024). Interindividual differences in pain can be explained by fMRI, sociodemographic, and psychological factors. Nature Communications 15, 7883.
4. Wager, T.D., Atlas, L.Y., Lindquist, M.A., Roy, M., Woo, C.-W., and Kross, E. (2013). An fMRI-based neurologic signature of physical pain. New England Journal of Medicine 368, 1388–1397.
5. Woo, C.-W., Schmidt, L., Krishnan, A., Jepma, M., Roy, M., Lindquist, M.A., Atlas, L.Y., and Wager, T.D. (2017). Quantifying cerebral contributions to pain beyond nociception. Nature Communications 8, 14211.
附件下载:

