心理所研究揭示丘脑特异的疼痛场电位响应信号
疼痛是一种不愉快的感官和情感体验,保护我们的身体免受实际或潜在的伤害。一方面,疼痛感知同时包含感官辨别信息和情感动机信息,这两类疼痛信息被认为分别通过大脑外侧和内侧疼痛通路进行传递和处理,丘脑及其皮质连接在这一过程中起着关键作用,其响应能够有效区分疼痛和非疼痛触觉刺激(Tu et al., 2024)。另一方面,多个丘脑核团被认为是深部脑刺激治疗慢性难治性疼痛的有效靶点,现有研究表明调控外侧疼痛通路中感觉性丘脑核团的镇痛效果并不令人满意,而内侧疼痛通路情绪相关靶点的干预或是增强镇痛疗效的有益补充(Meda et al., 2019; You et al., 2022)。然而,当前研究对丘脑的疼痛电生理响应的探索却十分有限,限制了靶向丘脑闭环神经调控治疗神经系统疾病的临床应用。
近期,中国科学院心理研究所胡理研究组开展了一项动物在体电生理研究(图1),通过两个实验记录了大鼠的外侧疼痛通路(丘脑腹外侧核团,ventral posterior lateral nucleus, VPL和初级躯体感觉皮层,primary somatosensory cortex, S1)和内侧疼痛通路(丘脑背内侧核,medial-dorsal nucleus, MD和前扣带皮层,anterior cingulate cortex, ACC)的激光诱发脑响应,利用多种电生理信号分析方法揭示了丘脑特异的疼痛场电位响应信号,表现为伤害性激光刺激呈现后约100ms出现的早期负波(early negativity, EN)。相关成果已在线发表于Research,题为Deciphering Authentic Nociceptive Thalamic Responses in Rats。
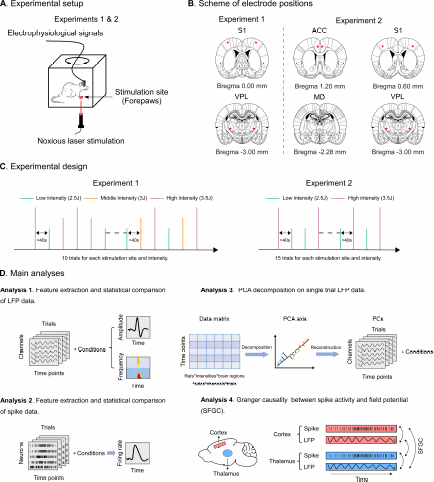
图1. 实验设计及主要分析方法
通过上述两个实验,获得了三个关键性结果:
其一,虽然丘脑表现出与皮层相似的伤害性诱发神经响应,但同步记录到的丘脑场电位响应在时间上落后于皮层响应(即时域N1成分)(图2),这与疼痛通路中信息上传的时间顺序相反,表明丘脑N1响应可能并非起源于丘脑,而是皮层N1信号体积传导的结果。
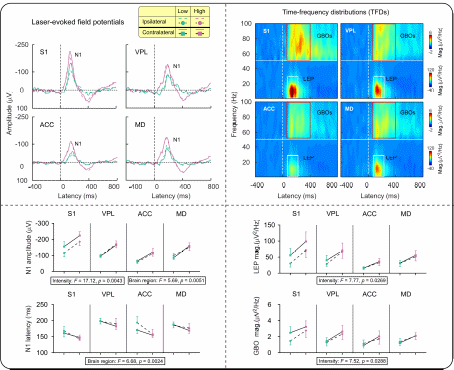
图2. 丘脑场电位中N1成分的峰值潜伏期显著晚于皮层N1 成分
其二,主成分分析在丘脑的疼痛场电位响应中揭示了一个独特的EN成分,该成分在VPL和MD中均可记录到,其振幅受到疼痛强度的显著调节,EN的峰值潜伏期显著短于随后的N1成分(图3),表明EN成分可能是丘脑特异的疼痛场电位响应信号。
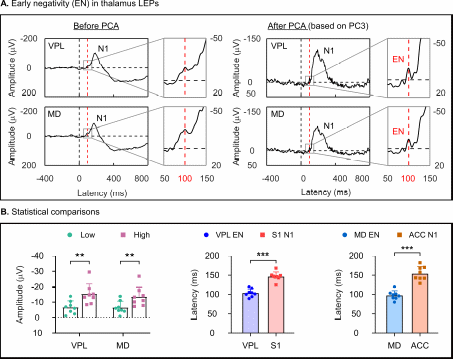
图3. 丘脑EN成分编码疼痛强度且峰值潜伏期显著短于皮层N1 成分
其三,丘脑和皮层之间的峰电位—场电位格兰杰因果分析(Spike-field Granger causality analysis)提供了支持性证据,丘脑峰电位在100ms左右对皮层场电位信号存在驱动性影响,这与EN的峰值潜伏期接近,并且丘脑到皮层的信息流显著早于皮层N1成分(图4)。
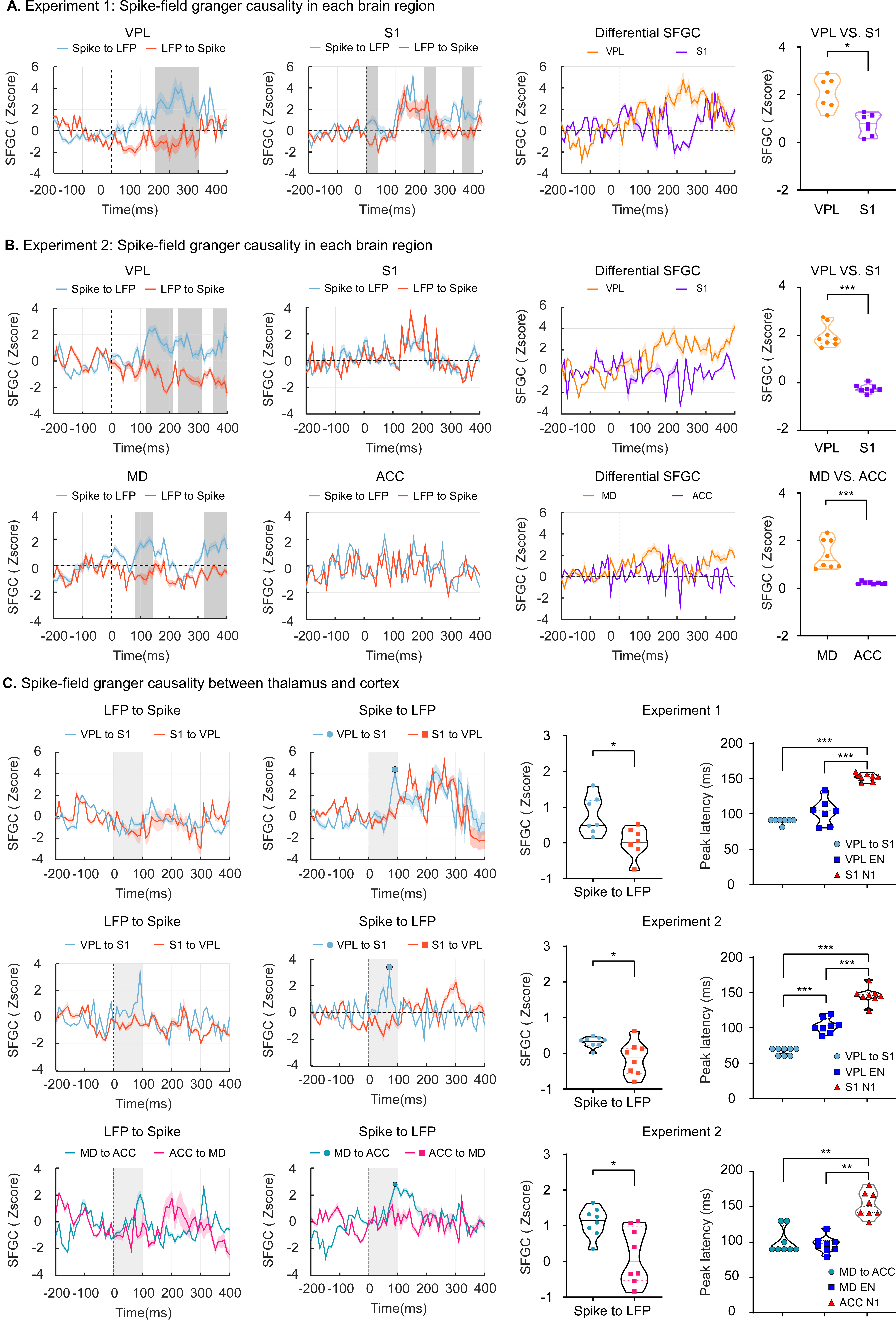
图4. 丘脑到皮层的信息流显著早于皮层N1成分
综上,该研究系统刻画了丘脑的疼痛电生理响应特征,揭示了丘脑特异的疼痛场电位响应信号,强调了分离真实丘脑神经响应的重要性,有助于更全面地了解丘脑在处理疼痛信息时的功能。此外,鉴于EN成分能够可靠编码疼痛强度信息,并且可能是一个普遍的丘脑特征,将EN成分纳入闭环神经调控系统实现疼痛的客观检测和评估,将有助于优化慢性疼痛的闭环神经调控效果,助力自适应和个性化的疼痛管理。
该研究得到了北京市自然科学基金(JQ22018)、国家自然科学基金项目(32071061)和科技部科技创新2030重大项目(2022ZD0206400)的支持。
论文第一作者为心理所博士生李镇江,通讯作者为胡理研究员,其他共同作者包括心理所博士生张立波(已毕业)、张峰瑞(已毕业)和助理研究员岳路鹏。
论文信息:
Li, Z., Zhang, L., Zhang, F., Yue, L., & Hu, L.* (2024). Deciphering Authentic Nociceptive Thalamic Responses in Rats. Research. https://spj.science.org/doi/10.34133/research.0348
相关论文:
Tu, Y., Li, Z., Zhang, L., Zhang, H., Bi, Y., Yue, L., & Hu, L. (2024). Pain-preferential thalamocortical neural dynamics across species. Nature human behaviour, 8(1), 149–163.
Meda, K. S., Patel, T., Braz, J. M., Malik, R., Turner, M. L., Seifikar, H., Basbaum, A. I., & Sohal, V. S. (2019). Microcircuit Mechanisms through which Mediodorsal Thalamic Input to Anterior Cingulate Cortex Exacerbates Pain-Related Aversion. Neuron, 102(5), 944–959.e3.
You, H. J., Lei, J., & Pertovaara, A. (2022). Thalamus: The 'promoter' of endogenous modulation of pain and potential therapeutic target in pathological pain. Neuroscience and biobehavioral reviews, 139, 104745.
附件下载:

